1. 前言
肥胖是一种慢性且复杂的疾病,其特征是体内脂肪过度沉积,对身体健康造成损害。肥胖会导致其他代谢疾病,包括2型糖尿病,高血压和心血管疾病。肥胖个体最明显的特征是脂质和能量代谢的失调,而线粒体功能障碍则进一步加剧了脂质和能量代谢的失衡。脂质代谢失衡,能量代谢失衡和线粒体功能障碍是诱导肥胖症的重要因素,这是减轻饮食诱导的肥胖症的潜在靶标。
在过去的十年中,最常用的减肥药物是西布曲明(Sibutramine)和奥利司他(Orlistat)。由于西布曲明副作用大,美国食品和药物管理局禁止使用。奥利司他也被报道会引起不良反应,如胃肠道疾病、肝损伤、过敏反应和异常内分泌系统反应。因此,从天然产品中找到潜在化合物来解决肥胖症至关重要。Adzuki Bean(Vigna AngularisL.)(红豆、赤豆)主要产地是中国和其他一些东亚国家。Adzuki Bean已被用作食品已有数千年了,它具有各种生物学活性,例如抗癌,抗糖尿病,抗氧化和肝脏保护。
作者之前的研究从红豆中提取了皂苷,并使用高效液相色谱-二极管阵列检测-电喷雾电离-串联质谱(HPLC-DAD-ESI-MSn)进行了鉴定;接着在高脂饮食诱导的肥胖小鼠模型中验证了红豆皂苷(adzuki bean saponins,ABS) 提取物的抗肥胖和降脂生物活性,特别是在肝脏和脂肪组织中。然而,红豆皂苷提取物抗肥胖效果的潜在分子机制,以及对细胞内线粒体的能量代谢和细胞内脂质代谢的影响仍然不明确。
因此,作者使用两个不同的细胞模型,旨在研究赤豆皂苷通过改善代谢障碍中的脂肪生成、脂质代谢和线粒体能量代谢,来实现抗肥胖生物活性的潜在作用和分子机制。
2.实验材料
1)赤豆皂苷
将赤豆称重为1kg并研磨成粉末。随后,使用10L 70%乙醇溶液对粉末状物质进行三次提取过程。合并所得混合物,过滤,然后进行浓缩过程以除去乙醇含量。剩余液体随后在室温下用3L石油醚进行三轮萃取处理,保留水性部分用于进一步研究。在室温下用3L正丁醇进一步萃取水性部分三次,收集有机层用于后续处理。然后,将蒸馏水加入到有机相中,并通过真空蒸发除去正丁醇。将得到的水溶液加入AB-8树脂柱中。接着,用水和45%乙醇洗涤,然后弃去洗脱液。最后,将80%乙醇加入AB-8树脂柱中,收集富集皂苷的洗脱液。洗脱液经冷冻干燥后为ABS。
2)游离脂肪酸
本文采用棕榈酸(钠)和油酸(钠)作为高脂细胞添加剂(货号KC006,Xi‘an Kunchuang Science and Technology Develop Co., Ltd. , 西安鲲创科技)作为游离脂肪酸(free fatty acids,FFAs)完成体外细胞实验。该高脂细胞添加剂中溶剂无毒、常温无析出、低温无析出、浓度精准,无需多次加热助溶,显著减少操作步骤,提升实验的稳定性。实际使用时,只需要将高脂细胞添加剂按照比例加入到完全培养基中即可。
 数据来源 http://www.xakckj.com.cn/
数据来源 http://www.xakckj.com.cn/
3.细胞培养及处理
HepG2细胞在37℃和5% CO2条件下,在补充有10%胎牛血清和1% 100×青霉素-链霉素溶液的MEM培养基中培养。该模型涉及用含有2:1油酸酯-棕榈酸酯的0.75mM游离脂肪酸(FFA)混合物孵育HepG2细胞。更具体地,用MEM必需培养基处理HepG2细胞24小时。接下来,用含有750μM FFA(游离脂肪酸;油酸钠-棕榈酸钠,2:1)的MEM必需培养基处理HepG2细胞24h,然后收获细胞用于进一步实验。治疗组在FFA的基础上加入不同剂量的ABS。
在37℃和5% CO2条件下,将3T3-L1细胞培养在添加10%胎牛血清和1% 100×青霉素-链霉素溶液的高糖DMEM培养基中。该模型涉及用脂肪形成分化培养基孵育3T3-L1细胞,所述脂肪形成分化培养基包括甲基异丁基黄嘌呤、地塞米松和胰岛素(MDI)。有两种脂肪形成分化培养基,A和B。脂肪生成分化培养基A(MDIA)含有0.5mM甲基异丁基黄嘌呤、1µM地塞米松和10µg/mL胰岛素(溶于含10% FBS的DMEM培养基中);脂肪生成分化培养基B(MDIB)含有10µg/mL胰岛素(溶于含10% FBS的DMEM培养基)。当3T3-L1细胞几乎完全生长时,使用脂肪形成分化培养基处理细胞以进行建模。将MDIA用于在有或没有不同剂量的ABS的情况下孵育3T3-L1细胞3天;将MDIB添加到3T3-L1细胞中在有或没有不同剂量的ABS的情况下孵育1天。4天为一个建模周期,正常情况下,整个脂肪细胞分化需要3-4个周期(12-16天)。
4.部分实验结果
1)ABS对HepG2细胞活力的影响
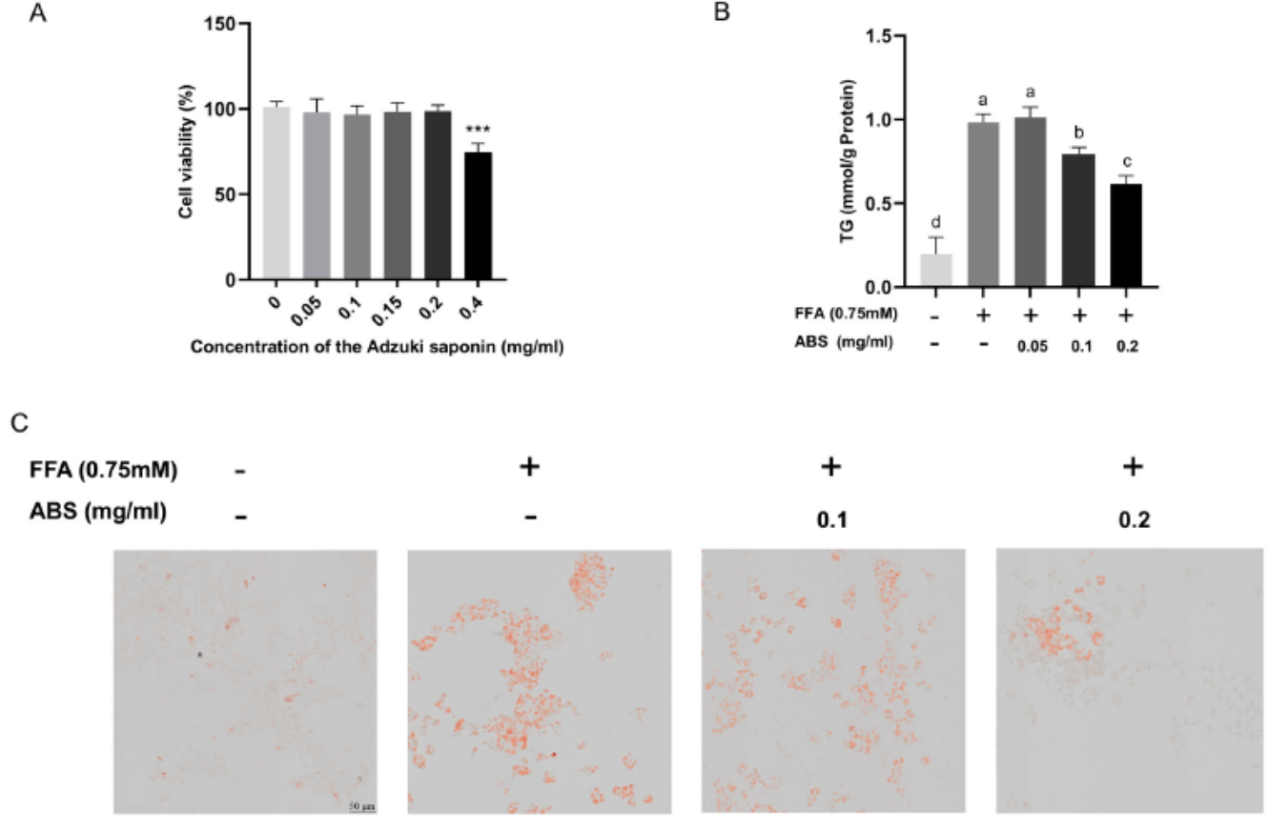
使用CCK 8方法评价ABS对细胞存活率的影响(图1A)。与对照组相比,浓度为0 ~ 0.2mg/mL的ABS作用HepG2细胞24 h后,对HepG2细胞的生长无明显抑制作用。当ABS浓度达到0.4mg/mL时,HepG2细胞的存活率明显下降。
图1 ABS对HepG2细胞的抗肥胖作用。(A)ABS对HepG2细胞活力的影响。*p<0.001。(B)ABS对HepG2细胞中甘油三酯(TG)含量的影响。(C)油红O(ORO)染色的游离脂肪酸(FFA)诱导的HepG2细胞模型,有或没有处理的红小豆皂苷(ABS)在不同剂量。通过具有40×物镜的VS200载玻片扫描仪系统(Olypums,Tokyo,Japan)的扫描系统捕获图像。比例尺,50μm。所有结果均表示为平均值±S.D,实验重复三次。根据ANOVA和Tukey多重范围检验,具有不同字母(a-d)的条显著(p<0.05)不同。
2)ABS抑制细胞内脂质积聚
采用不同剂量的ABS处理模型HepG2细胞,探讨ABS对脂质沉积的抑制作用。我们测定了TG含量(图1 B)。结果表明,模型组细胞内TG含量较对照组显著升高,ABS在0.1 ~ 0.2mg/mL剂量范围内呈剂量依赖性降低细胞内TG含量。此外,0.05 mg/mL ABS处理未显示任何影响。我们进一步研究中的剂量设定为最高0.1 mg/mL和0.2 mg/mL。我们还使用ORO染色来评估脂滴产生(图5C)。结果还表明,0.1 mg/mL和0.2 mg/mL ABS都可以减少脂滴的产生,这在细胞内TG含量测试中是相似的。
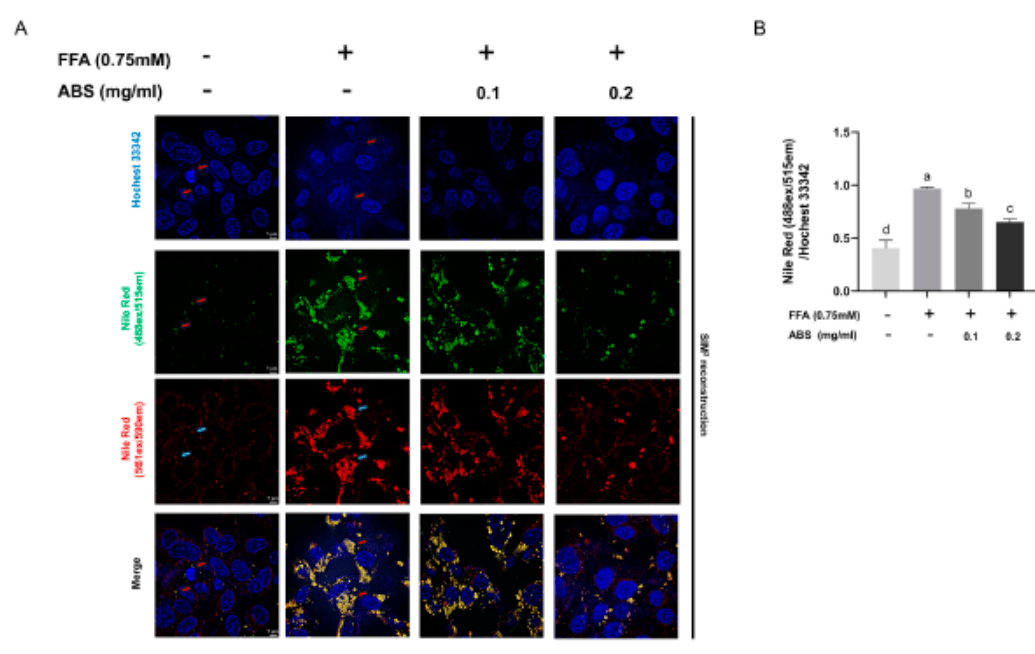
此外,我们还进行了尼罗红和Hochest 33342双染色(图2)。尼罗红(NR)是一种亲脂性染色,与脂质相互作用后具有强烈的红色荧光信号(~552 ex/635 em)。由于NR与细胞膜脂双层结合也会诱导强红色信号,并且考虑到NR与细胞内脂滴结合会诱导特异性绿色荧光信号的事实(~488 ex/528 em),使用了两台超高速摄像机和一个长通滤波器(LP 560)来捕捉绿色(488 ex/495~550 em)和红(561 ex/570~620 em)信号。
图2 ABS可减轻FFA介导的脂质聚集。(A)用Hochest33342(蓝色)和尼罗红(绿色和红色)共染色的HepG2细胞的荧光图像,由蔡司Elyra7使用配备63×油浸物镜的点阵结构照明显微镜(SIM)2超分辨率荧光显微镜拍摄。比例尺,5µm。(B)基于SIM2拍摄的荧光信号和ImageJ拍摄的脂滴原始图像的半定量分析。所有结果均表示为平均值±S.D,并重复三次实验。根据ANOVA和Tukeys多重范围检验,具有不同字母(a-d)的柱显著(p<0.05)不同。
5.讨论
本研究首先利用UHPLC-QEMS技术鉴定了ABS中的15个皂苷成分,并利用网络药理学集成生物信息学技术分析了ABS通过改善脂肪代谢实现抗肥胖生物活性的潜在机制。在HepG2细胞模型中验证了ABS可以改善脂肪代谢并增强线粒体功能以减少脂质积聚。基于网络药理学预测,PI3K/Akt信号通路被证明与ABS的抗肥胖功效具有显著相关性。结合ABS对线粒体功能的增强作用,后续的实验证实ABS在脂质沉积细胞模型(HepG2细胞系)中调节PI3K/Akt/GSK 3 β/β-catenin信号通路相关蛋白和下游转录因子c-Myc。此外,ABS还可通过调节β-catenin信号及其下游脂肪形成转录因子C/EBPα,在脂肪细胞(3T3-L1细胞系)中发挥抗肥胖作用。综上所述,ABS可以通过改善脂质蓄积、脂质代谢、肝细胞线粒体异常和脂肪细胞脂肪生成来达到抗肥胖作用。ABS在肝脏和白色脂肪组织中的作用机制有待于进一步的体内研究。更具体地,肝脏是ABS改善脂质代谢和线粒体异常的靶器官;同样,白色脂肪组织是ABS抑制脂肪生成的靶器官。这些发现为ABS通过改善脂肪代谢和促进线粒体功能正常化来实现减肥效果提供了实质性支持,为其进一步开发奠定了基础。
小编有话说:
HepG2细胞脂质沉积与代谢紊乱的改善是当前研究的热点领域。目前,大多数研究人员普遍采用500 μmol/L棕榈酸(钠)联合250 μmol/L油酸(钠)作用24至72小时的技术方案,在体外诱导HepG2细胞以构建脂质沉积细胞模型。一些研究人员也会单独使用棕榈酸(钠)或油酸(钠)进行诱导,由于HepG2细胞本身较为敏感,某些情况下单独使用其中一种脂肪酸也能获得理想的实验结果。然而,从机制上讲,棕榈酸(钠)主要诱导细胞损伤和炎症反应,而油酸(钠)主要促进细胞脂质沉积。因此,在研究非酒精性脂肪性肝病(NAFLD)时,更推荐采用棕榈酸(钠)与油酸(钠)联合诱导的技术方案,这样不仅能更好地模拟人体内的病理生理环境,还能提高实验结果的可靠性和科学性。
参考文献
Jinhai Luo, Jincan Luo ,et al. Anti-Obesity Effects of Adzuki Bean Saponins in Improving Lipid Metabolism Through Reducing Oxidative Stress and Alleviating [J], Antioxidants,2024.返回搜狐,查看更多